钙化性主动脉瓣膜狭窄:基于组学的靶点发现与治疗发展
钙化性主动脉瓣膜狭窄:基于组学的靶点发现与治疗发展

钙化性主动脉狭窄:基于组学的靶点发现与治疗发展
Calcific aortic stenosis: omics-based target discovery and therapy development

文案、排版设计:张慜歆(武汉大学第二临床学院2021级临五)
指导、审核:王霜
2025年2月,来自哈佛医学院的Mark C Blaser等人在European Heart Journal上发表了名为钙化性主动脉瓣膜狭窄:基于组学(包括(表观)基因组学、转录组学、蛋白质组学和代谢组学)的靶点发现与治疗发展的综述,汇总了主动脉瓣膜钙化导致的主动脉瓣膜狭窄(AS)在组学视角下发病机制、疾病进展、药物靶点和治疗方法,还讲述了组学视角下与钙化性主动脉瓣膜疾病有关的炎症驱动问题、VICs转分化问题、细胞外囊泡问题、性别特异性问题等。此外还探讨了组学快速发展背景下将如何提高组学在AS中获得成果的临床转化率。
原文信息:European Heart Journal (2025) 46, 620-634
https://doi.org/10.1093/eurheartj/ehae829
钙化性主动脉瓣疾病(CAVD)导致的主动脉瓣狭窄(AS)是一种常见的心脏瓣膜病,在 65 岁以上人群中的发病率为 2%.出现症状性重度主动脉瓣狭窄的患者,如果不进行瓣膜置换,平均剩余寿命不到 2 年。目前治疗方法主要是行外科主动脉瓣置换术(SAVR)或经导管主动脉瓣置换术(TAVI),尚无获批用于治疗主动脉瓣狭窄的药物,这主要是因为CAVD的血流动力学复杂,研究者们难以了解清楚具体的分子机制。近期对CAVD的单细胞组学研究激增,而组学研究的结果将如何应用于解读该疾病的发病机制和研发潜在药物是具有重要意义的。
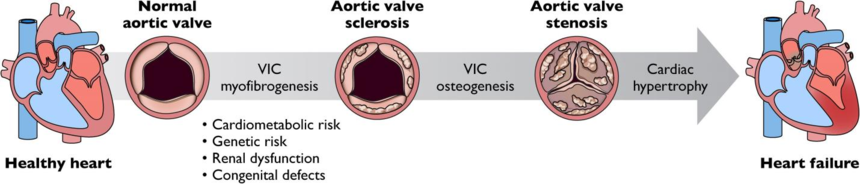
Figure1.钙化性主动脉瓣膜狭窄的疾病进展过程
钙化主动脉瓣狭窄是一种缓慢进展的慢性疾病,与代谢、遗传、肾脏和先天性等多种危险因素有关,瓣膜间质细胞转分化,导致成纤维细胞和成骨细胞形成;在主动脉瓣的阻塞并未影响运动时的心脏输出量的正常增加之前,患者通常没有症状。但是随着主动脉瓣叶增厚并钙化,收缩期开口减小,左心室后负荷会不断增加,并引发心肌肥厚。若不进行治疗,这些患者通常会迅速发展为心力衰竭。
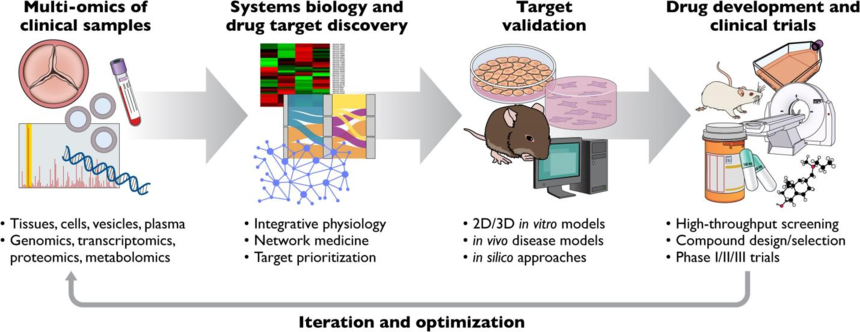
Figure2.多组学:从“理解疾病”到“治疗疾病”
根据研究目标(例如发病机制、细胞类型特异性靶点、生物标志物)的不同,可以选择不同组织来源(例如瓣膜细胞、组织、血清、血浆)的细胞外囊泡或相关样本进行筛选研究。通过量化不同实验组之间的分子丰度差异,在多组学(基因组学、转录组学、蛋白质组学、代谢组学)的见解下,通过网络分析无偏倚地对靶点进行优先级的排序,得出后续用于转化研究的靶点列表。通过计算机模拟、体外疾病模型、体内疾病模型验证某靶点与CAVD发病机制有关的特点方面,然后在现有的小分子文库中进行高通量测序,以设计靶向生物制剂或开发药物,实现“组学应用的真正转化”。
类别 | 基因组学 | 转录组学 | 蛋白质组学 | 代谢组学 |
目的 | 确定风险位点和相关的SNPs | 确定病变瓣膜组织中差异表达的基因 | 关注病变组织中发生改变的蛋白质 | 关注病变组织中发生改变的代谢物 |
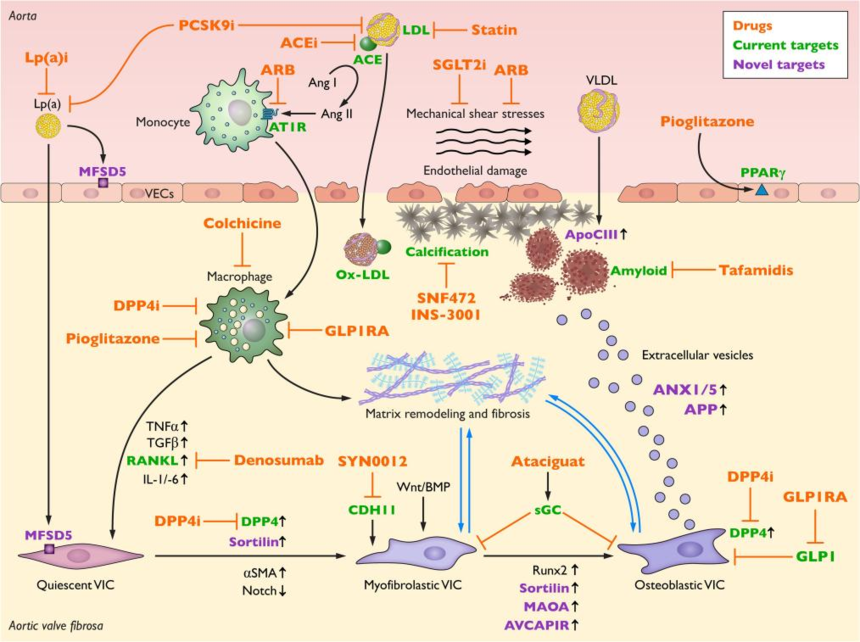
Figure3:主动脉瓣狭窄的疾病机制、药物靶点和药物治疗
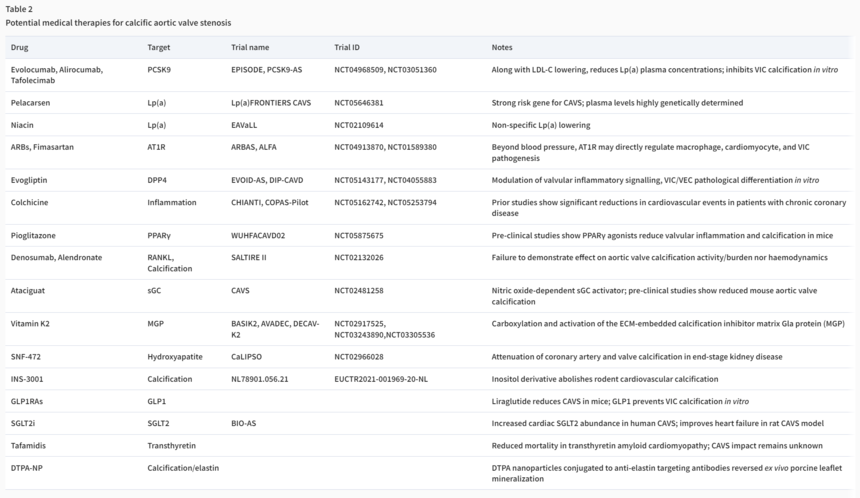
LDL-C是AS的明确风险因素,但是他汀类药物并未展现出阻止CAVD发生发展的作用。加上十年前的一项全基因组关联研究(GWAS)和孟德尔随机化(MR)研究证明了循环 Lp(a)水平的改变与AS具有显著的因果关系,于是出现了所谓的降脂疗法;包括LDL受体降解物PCSK9 抑制剂、Lp(a)受体 / 辅助因子MFSD5抑制剂、贝特类药物或二十碳五烯酸乙酯靶向降低瓣膜钙化区富集的apo-CIII。Lp(a)携带的氧化磷脂可以直接刺激瓣膜细胞的成骨分化,而LDL的氧化产物也可以诱导炎症反应和细胞损伤,因此使用贝特类药物和烟酸直接降低细胞外脂质水平也是有潜力的治疗方法。
细胞外基质(ECM)的组成和结构在CAVD中发生了变化,导致纤维化和矿化增加。因此可以调控ECM重塑过程中的关键酶以维持ECM的稳定性:抑制过度活跃的基质金属蛋白酶(MMPs)可以减少 ECM 的降解,而增强组织金属蛋白酶抑制剂(TIMPs)的活性可以平衡 MMPs 的作用。
细胞外囊泡(EVs)是近年来备受关注的细胞外靶点。EVs是由细胞分泌的微小囊泡,来自钙化瓣膜细胞的EVs含有促进钙化的钙结合蛋白和骨相关蛋白,可以被邻近的瓣膜细胞摄取,从而诱导邻近瓣膜细胞发生钙化。因此,干扰EVs的产生、释放或摄取过程,可能是阻止CAVD发展的有效方法。例如,通过抑制参与EVs形成的关键蛋白或使用药物阻断EVs与受体细胞的结合,可以减少促钙化信号的传递。
炎症细胞因子和趋化因子是细胞外环境中的另一类重要分子,它们在CAVD的炎症反应中起着关键作用。在疾病状态下,肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)和干扰素-γ(IFN-γ)大量释放,这些因子可以激活瓣膜细胞内的炎症信号通路,促进细胞的成骨分化和钙化。因此,使用单克隆抗体阻断TNF-α或IL-6的活性,有可能应用于 CAVD 的治疗。
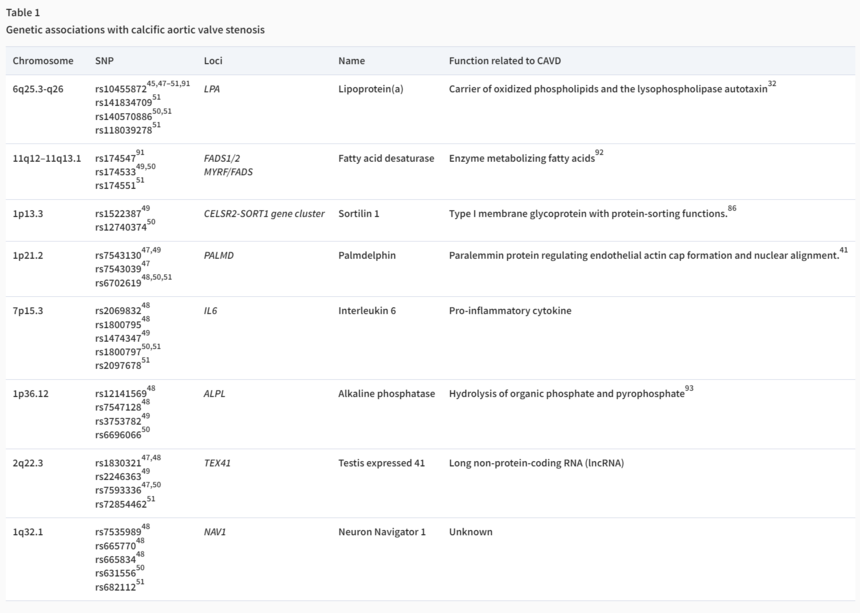
①全基因组关联研究(GWAS)中,我们发现转录因子GATA 4失功能变异、有害MUC4水平上升、PALMD失功能变异、TEX41和MIB1失功能变异均为二叶式主动脉瓣(BAV)的相关风险位点。此外与CAVD有关的风险位点还有IL6 、ALPL、CEP85L、FTO、LMAP、CELSR2-SORT1、MECOM、CDAN1、NLRP6 、SMC2等。
②表观遗传学的研究证明:a、低甲基化驱动了lncRNA H19的表达,损害了NOTCH信号传导,并导致心脏瓣膜间质细胞(VICs)钙化;b、磷脂酰肌醇酸酯酶-3(PLPP3)内含子增强子甲基化减弱了[Lp(a)]代谢物的降解,并驱动促成骨性VIC反应。
③在非编码PIWI相互作用RNA(piRNA)的测序中 发现了升高的hsa-piR-25624,质谱蛋白质组学中发现了其结合体m6A甲基转移酶(FTO),在RNA-seq中又发现hsa-piR-25624和FTO的结合介导了CD36mRNA的去甲基化,促进产生了促钙化的PCSK9蛋白。
④RNA-seq揭示了不确定潜能的克隆性造血驱动突变(CHIP)携带者心脏瓣膜中的广泛炎性细胞(尤其是B细胞)浸润和炎性信号传导。
⑤RNA-seq表明Y染色体镶嵌性缺失(LOY)似乎与AS中TGF-β介导的促纤维化转录程序有关。
⑥转录组学研究发现,升高的Rho相关蛋白激酶(ROCK)信号使避免基因BMX和STS失活,从而增强雌性VIC的肌纤维母细胞生成。
⑦转录组学和脂质组学揭示FADS基因型与脂肪酸去饱和酶(FADS)mRNA表达、组织脂肪酸Ω-3多不饱和脂肪酸(n-3 PUFAs)含量/代谢和瓣叶钙化有关。
随着数据库的扩大,在结合临床数据后借助大规模队列分析和孟德尔随机化方法,我们会不断深入对CAVD导致的AS的认识,多组学推进着首批非基因靶点药物向临床应用转化。针对疾病不同阶段(如早期启动、中期纤维化、晚期钙化)的单细胞研究将有助于更好地理解CAVD不同疾病阶段连续的病例生理学变化;蛋白质组学技术的发展或可检测与AS有关的循环生物标志物,用于预测AS的风险因素、早期诊断、疾病进展情况。
然而随着组学的发展,易于检测的和相关性更大的靶点被逐渐发现,我们将会需要更大规模的队列和更昂贵的测序来识别出一些不容易被检测出来的、效应不够明显的靶点,这就会使得付出和收益不成正比,这个问题则值得深思。并且在组学中获得的成果是否能顺利转化入临床应用,这就促使我们在Figure2的各个环节中“多管齐下”。并且,组学会成为自身成功的“受害者”,在TAVI时代,SAVR的手术量急剧下降,由SAVR手术得到的人类组织样本会变得越来越少,这就促使我们开发更加适配的动物模型和其他CAVD 3D模型,这将成为我们研究疾病机制和发现有意义靶点、并真正应用到临床的关键。
武汉大学中南医院心血管外科
武汉大学第二临床学院
欢迎联系我们、加入我们



文案&设计&排版:张慜歆
审核:王霜
联系与投稿方式:296130449@qq.com
推荐
-

-

QQ空间
-

新浪微博
-

人人网
-

豆瓣


都在搜:主动脉瓣狭窄指南共识