基于壳聚糖/透明质酸双层聚阴离子涂层的智能抗菌生物人工心脏瓣膜研究
基于壳聚糖/透明质酸双层聚阴离子涂层的智能抗菌生物人工心脏瓣膜研究

基于壳聚糖/透明质酸双层聚阴离子涂层的智能抗菌生物人工心脏瓣膜研究
Research on intelligent antibacterial biological artificial heart valve based on chitosan/hyaluronic acid bilayer polyanionic coating

翻译、文案:孟庆博(武汉大学第二临床学院2022级临八)
排版设计:蒋润琦(武汉大学基础医学院2023级临床五加三)
指导、审核:王霜 张慜歆
针对心脏瓣膜术后钙化与感染性心内膜炎的临床难题,我们研发出基于壳聚糖/透明质酸双层涂层的智能人工瓣膜——通过高压碳酸溶液绿色工艺构建,实现抗钙化(动物实验钙化减少99.2%)、感染微环境触发万古霉素精准抗菌(24小时抑菌圈27mm,细菌存活率降至0.3 Log)及力学强化(拉伸强度提升15%-30%)三重突破,为心脏瓣膜革新提供新策略,并有望拓展至血管补片、骨修复等领域,推动抗感染植入器械临床转化!
随着老龄化的加剧,心脏瓣膜疾病在全球的发病率逐年攀升,人工心脏瓣膜置换术是治疗严重心脏瓣膜病变的主要手段。然而,目前广泛使用的生物瓣膜(如戊二醛交联的牛心包瓣膜)仍面临两大核心问题:术后钙化和感染性心内膜炎。钙化主要由残留的醛基引发异位矿化,而感染则与细菌在材料表面定植形成生物膜相关。传统解决方案(如表面化学修饰或抗生素负载的人工瓣膜)常存在药物释放不可控、机械性能下降或生物相容性不足等缺陷。本研究创新性地将生物瓣膜壳聚糖(Chitosan)和透明质酸(Hyaluronic Acid, HA)两种天然聚电解质相结合,在高压碳酸溶液体系中构建智能响应型双层涂层,旨在同步解决上述问题。
2.1 材料与设备
胶原基质:采用戊二醛(0.625%)交联的牛心包组织,经标准化清洗与灭菌处理。
聚合物原料:壳聚糖(Sigma-Aldrich,分子量210 kDa,脱乙酰度16-24%)、透明质酸钠(Lifecore Biomedical,分子量150-300 kDa)、万古霉素(Sigma-Aldrich)。
高压反应系统:30 mL不锈钢反应釜(INEOS RAS),压力范围6–50 MPa,CO₂纯度>99.995%。
表征仪器:傅里叶变换红外光谱(FT-IR,Thermo Nicolet IS5)、场发射扫描电镜(FE-SEM,Hitachi SU 8000)、透射电镜(TEM,LEO 912 AB Ω)、原子力显微镜(AFM,Digital Instruments)及力学测试机(Instron)。
2.2 涂层制备流程
1.壳聚糖溶液制备:将壳聚糖粉末分散于去离子水中,注入液态CO₂至30 MPa,磁力搅拌5–7天,形成pH≈3的均匀溶液(图1a)。
2.逐层沉积:
第一层(壳聚糖):将牛心包胶原片浸入壳聚糖溶液,30 MPa下反应3小时,通过氨基与戊二醛的共价键结合固定(图1b)。
第二层(万古霉素):在HEPES缓冲液(pH 5.0–6.0)中负载万古霉素,高压渗透至壳聚糖层(图1c)。
第三层(HA):在碳酸溶液中沉积HA,利用壳聚糖的阳离子特性通过静电作用形成致密聚阴离子层(图1d)。
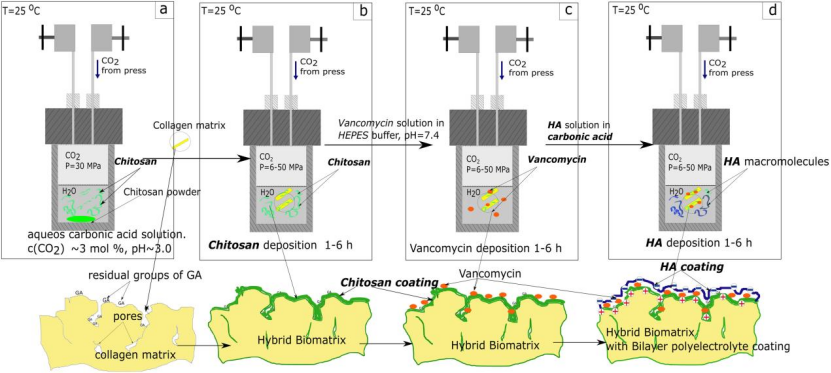
图1.通过在高压下从二氧化碳饱和的水溶液中顺序直接沉积而形成具有聚电解质涂层的生物基质的示意图:a)将壳聚糖溶解在碳酸中,b)将壳聚糖从碳酸溶液中沉积到牛心包的GA稳定的胶原基质上,c)在高压下将万古霉素从CO2饱和的HEPES溶液中沉积到杂化生物基质上,d)HA从混合生物基质的碳酸溶液中沉积。
示例的代码 | 描述 |
Coll | GA 稳定的牛心包 |
Coll_Chit | GA 稳定的牛心包,具有由碳酸沉积的壳聚糖涂层 |
Coll_Chit/Vanc | Coll_Chit 样品中含有万古霉素,沉积自 CO2饱和的 HEPES 缓冲溶液在 30 MPa 的压力下 (pH = 5.0–6.0) |
Coll_Chit/Vanc/HA | 从碳酸沉积的透明质酸涂层的 Coll_Chit/Vanc 样品 |
Coll_Chit/HA | Coll_Chit 由碳酸沉积的透明质酸涂层样品 |
表 1.实验样品的描述
3.1吸附优化性:
HA吸附效率提升:与传统水溶液法相比,30 MPa高压下HA负载量从2.2%提升至6.0%(图2a),归因于CO₂增压促进聚合物链渗透至胶原孔隙。 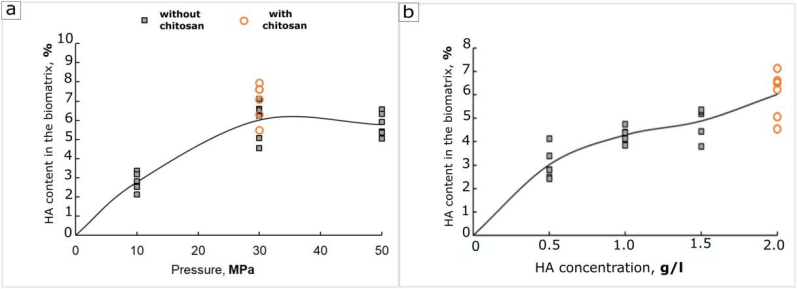
图2.在施用碳酸溶液重量时,吸附的 HA 聚阴离子对基材(GA-胶原基质)的依赖性。%: a) 来自施加的压力(HA 溶液的浓度为 2 g/l.),b) 来自 HA 浓度。温度 T = 25 °C,应用时间为 3 小时。
3.2结构稳定性与生物相容性:
FE-SEM/TEM:观察涂层对胶原纤维的覆盖效果及孔隙填充(图4-6),HA层厚度达17 nm(表3)。TEM显示HA层完全覆盖胶原纤维(图5b),SEM证实涂层减少表面孔隙率(图6c)。组织学切片显示涂层处理后的胶原纤维排列更致密,细胞残留减少(图6d-f),表明高压工艺对基质无破坏。
AFM:模型云母基底上,壳聚糖呈伸直构象(高度0.8–1.0 nm),HA在壳聚糖层上形成均匀覆盖(高度6–10 nm,图7)。

图4.胶原蛋白基质两侧表面的 SEM 图像:Coll、Coll_Chit、Coll_Chit/Vanc Coll_Chit/HA。每侧的上行增加 ×5 k,下行增加 ×20 k。上行中的矩形突出显示了下行中放大所表示的区域。

图5. GA 交联的超薄切片的 TEM 图像 a) 壳聚糖包被的胶原组织,b) 壳聚糖/透明质酸包被的胶原组织。聚合物固定相为中灰色,用虚线突出显示。
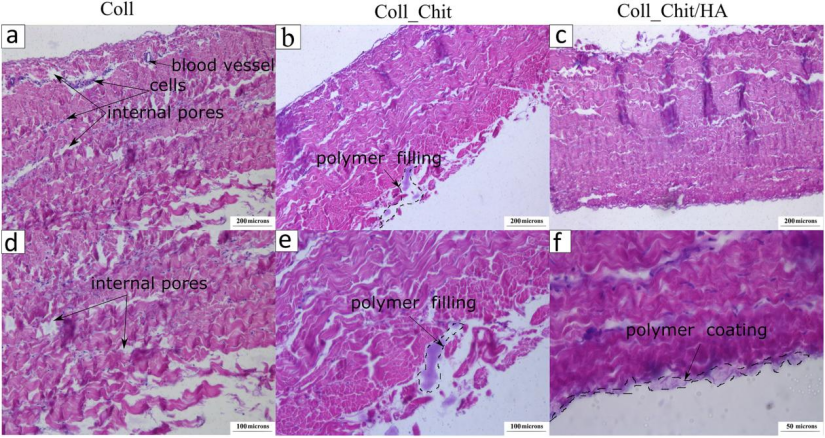
图6.心包组织样本的切片:a) Coll,b) Coll_Chit,c) Coll_Chit/HA,(×100,刻度线 — 300 μm)。相同样品的更高分辨率图像:d) Coll,e) Coll_Chit,(×200,刻度线 — 200 μm),f) Coll_Chit/HA(×400,刻度线 — 50 μm)。用苏木精-伊红、UV 染色。胶原蛋白和弹性蛋白纤维在所有图像中都完全保留下来,并呈粉红色,细胞和细胞残基呈蓝色。观察到胶原纤维的浓缩和重新排序,并伴有组织修饰的复杂性(从a)到 c))。主要特征由图中的箭头表示。
样本 | 原纤维平均直径,nm | 涂层厚度,nm |
Coll | 65 ± 10 | 无涂层 |
Coll_Chit | 75 ± 10 | 5.0 ± 0.5 |
Coll_Chit/Vanc | 77 ± 12 | 6.0 ± 1.0 |
Coll_Chit/HA | 100 ± 15 | 17.0 ± 3.0 |
表3.通过比较分析其胶原纤维的平均直径来估计生物聚合物包被的胶原蛋白基质的涂层厚度。
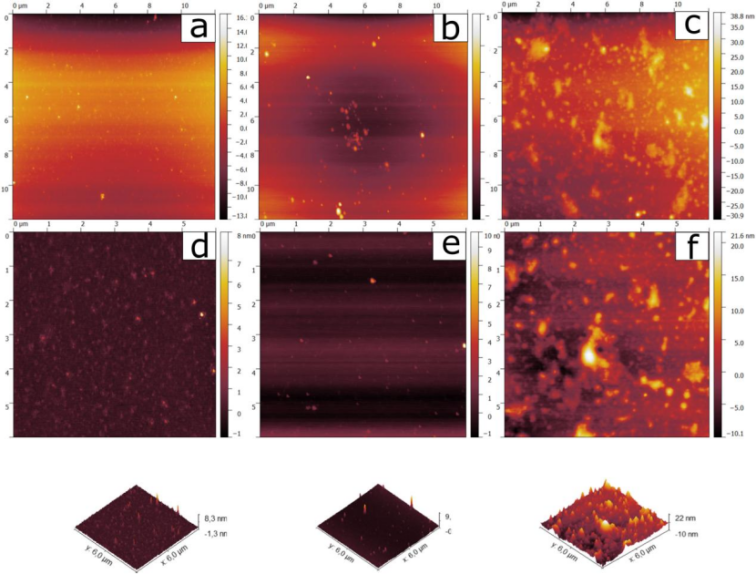
图7.聚合物涂层沉积在二氧化碳饱和水溶液中现磨云母模型基材上的AFM 图像:a) d) 壳聚糖大分子;b),e) 透明质酸的吸附结构,c) f) 通过连续应用成分获得的壳聚糖\万古霉素\透明质酸涂层。上行是扫描区域的大小 12 ∗ 12 μm2,中间行是扫描区域的大小8 ∗ 8 μm2.底行是相应上排样品的具有吸附结构的基材的 3D 图像。
3.3力学强化性:沿胶原纤维轴向/径向进行拉伸实验,计算杨氏模量及断裂强度(图8,表4)。
结果表明HA填充胶原孔隙,轴向拉伸强度提升15%(25.0MPa vs. 22.0MPa),径向提升30%(12.0MPa vs. 9.5MPa),初始杨氏模量增加130%(表4)。
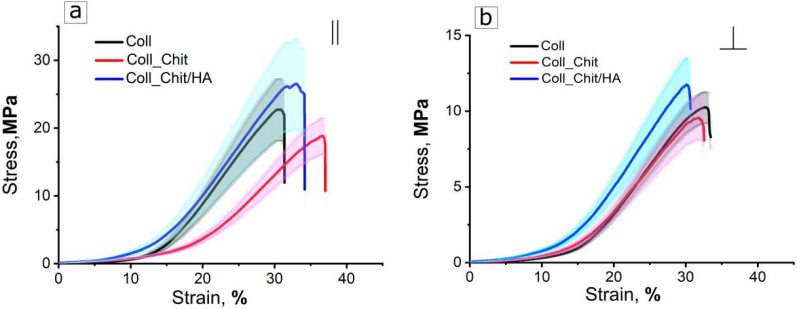
图8.相对于胶原纤维方向,在(a) 轴向和 (b) 径向上有和没有生物聚合物涂层的GA 交联胶原蛋白基质样品的典型应力-应变曲线。黑色控制曲线是指在用聚合物包覆之前经过 GA 处理的样品。彩色曲线适用于从碳酸溶液中沉积的壳聚糖(红色)和聚电解质壳聚糖/HA(蓝色)涂层涂层的样品。误差区间由半透明区域表示(n = 5 个样品每次测量的统计偏差):灰色 - 用于对照样品,粉红色 - 用于具有壳聚糖涂层的基质,绿松石色 - 用于具有壳聚糖/透明质酸涂层的基质。
样本 | 施加载荷的方向 | 极限抗拉强度(σ),MPa | 断裂应变(ɛ), % | 初始杨氏模量(E低)、MPa | 最终杨氏模量(E高)、MPa |
Coll | ‖ | 22.0 ± 5.0 | 34 ± 6 | 2.5 ± 0.2 | 140 ± 20 |
ꓕ | 9.5 ± 1.1 | 31 ± 2 | 1.1 ± 0.3 | 60 ± 5 | |
Coll_Chit | ‖ | 20.0 ± 3.0 | 40 ± 2 | 3.1 ± 0.7 | 110 ± 20 |
ꓕ | 10.0 ± 2.0 | 33 ± 1 | 1.3 ± 0.6 | 60 ± 7 | |
Coll_Chit/HA | ‖ | 25.0 ± 5.0 | 37 ± 7 | 5.8 ± 1.6 | 125 ± 20 |
ꓕ | 12.0 ± 2.0 | 33 ± 4 | 3.1 ± 1.6 | 70 ± 10 |
表 4.在两个主要正交方向上切割的胶原蛋白生物基质的应力-应变行为特征总结。测试对照样品(初始,仅通过 0.625% GA 稳定)、壳聚糖涂层样品和壳聚糖/HA 涂层样品(在碳酸聚合物溶液中处理)。所有结果均显示为均值±标准误差 (N = 5,p < 0.05)。
3.4抗菌与释放智能性:
感染时,细菌分泌的透明质酸酶水解HA外层,释放内嵌的万古霉素(图12)。体外抑菌:通过抑菌圈法(图9)和细菌黏附/存活实验(图10)评估涂层对金黄色葡萄球菌(S.aureus)的抑制效果。
体外实验显示,含万古霉素的涂层在24小时内形成27 mm抑菌圈(表5),细菌存活率降至0.3 Log(CFU)(表6)。
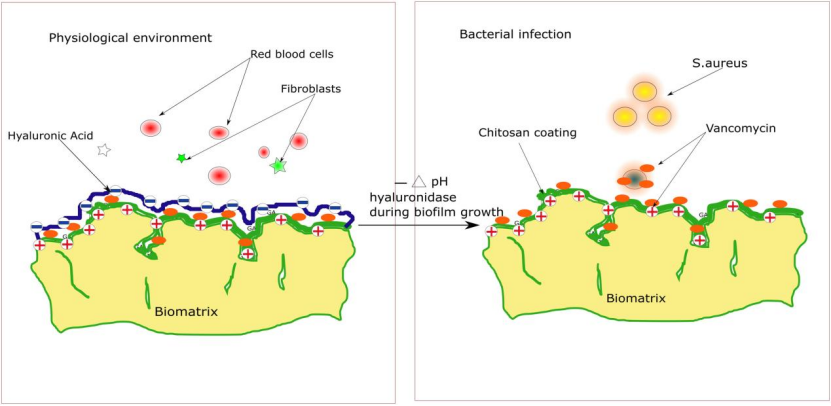
图9.掺杂抗生素的双层聚电解质涂层的生物基质的“智能”抗菌反应方案。
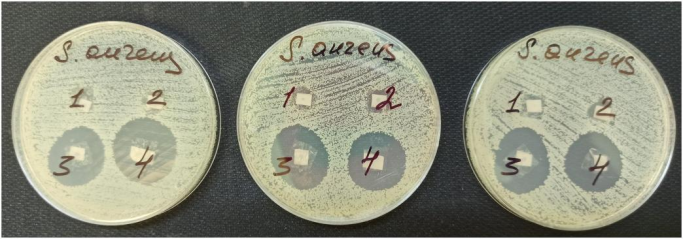 图10.用于冷凝聚合物膜的金黄色葡萄球菌培养物的裂解区:(“1”)从碳酸溶液中倒出的壳聚糖薄膜;(“2”)–从碳酸溶剂中倒入的 HA 薄膜;(“3”)–从壳聚糖和万古霉素的碳酸溶液中倒入的薄膜;(“4”)是通过在壳聚糖和万古霉素已经形成的薄膜“3”上浇水而获得的薄膜。
图10.用于冷凝聚合物膜的金黄色葡萄球菌培养物的裂解区:(“1”)从碳酸溶液中倒出的壳聚糖薄膜;(“2”)–从碳酸溶剂中倒入的 HA 薄膜;(“3”)–从壳聚糖和万古霉素的碳酸溶液中倒入的薄膜;(“4”)是通过在壳聚糖和万古霉素已经形成的薄膜“3”上浇水而获得的薄膜。
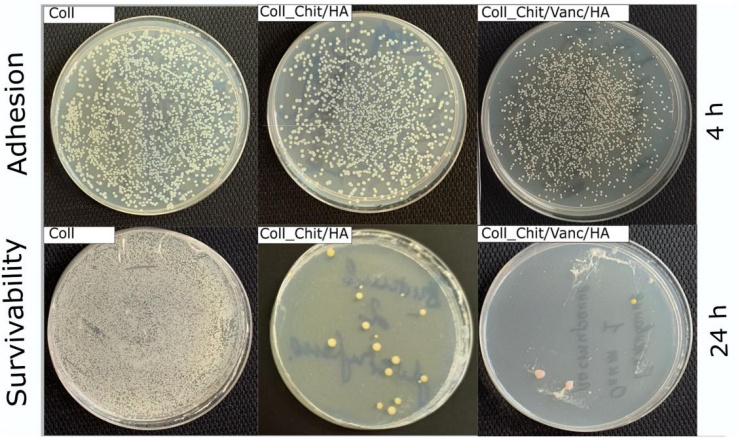
图11.Coll、Coll_Chit/HA、Coll_Chit/Vanc/HA 样品相对于金黄色葡萄球菌的杀菌效果。将金黄色葡萄球菌悬浮液与样品一起孵育4 小时观察细菌在材料上的附着性,孵育 24 小时后观察细菌的存活率。
表 5.分析金黄色葡萄球菌培养物的裂解区,用于浓缩纯聚合物膜(壳聚糖、HA)和万古霉素。
样本 | 样品描述 | 裂解区(Δσ), mm | 裂解区平均值,(<Δσ>),mm | ||
#1 | #2 | #3 | |||
1 | 壳聚糖(缩合膜) | 0 | 0 | 0 | 0 |
2 | HA (缩合膜) | 1 | 1 | 1 | 1 |
3 | 壳聚糖 + 万古霉素(缩合膜) | 25 | 25 | 25 | 25 |
4 | 壳聚糖 + 万古霉素/HA(缩合膜) | 27 | 25 | 27 | 26.3 |
表 6.根据图7 中对 Coll、Coll_Chit/HA、Coll_Chit/Vanc/HA 样品的杀菌效果结果计算金黄色葡萄球菌的粘附指数和存活指数。
样本 | Coll | Coll_Chit/HA | Coll_Chit/Vanc/HA |
附着力(Log (CFU)) | ~3.18 | ~2.86- | ~2.74 |
生存能力(Log (CFU)) | ~5 | ~1.40 | ~0.3 |
3.5 pH响应特性:
模拟感染微环境(pH5.0+透明质酸酶),检测HA层酶解触发的万古霉素释放动力学。结果表明正常生理环境(pH 7.4)下,HA层稳定(90%保留率),而在感染微环境(pH5.0+酶)中,HA快速降解(70%释放),万古霉素释放量显著增加(图11)。
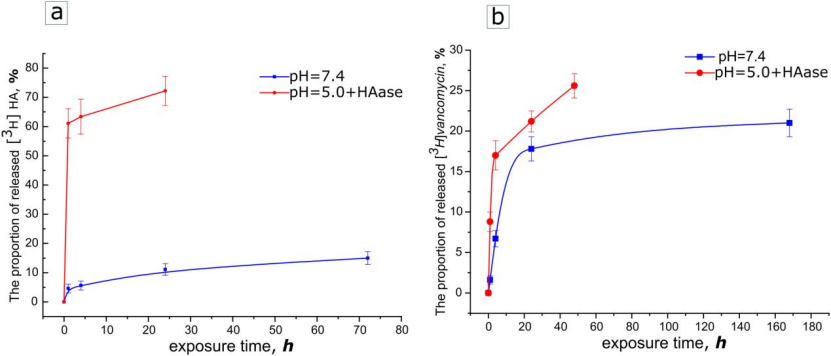
图12. 在 pH = 7.4(黑色曲线)的醋酸盐缓冲培养基中,以及在 pH = 5.0 添加透明质酸酶 (c = 10 g/l) 的情况下释放含有万古霉素的双层聚合物涂层的成分,这模拟了病原微生物群落的生长:a) 释放曲线 [3H]HA、b) 释放曲线[3H]万古霉素。
3.6抗钙化性:
将涂层样品植入Wistar大鼠皮下,4个月后通过原子吸收光谱测定钙含量。结果表明壳聚糖通过氨基屏蔽戊二醛残留醛基,结合HA的亲水屏障作用,使大鼠皮下钙化降低99.2%(表7)。
表7.不同牛心包样本的钙化相对减少:大鼠皮下钙化试验的结果。标准化钙的量计算为修饰样品中检测到的平均钙含量与参考牛心包样品中检测到的平均钙含量之间的比率,就像通过 GA 稳定制备的那样(将两种类型的样品块联合植入每只大鼠后4 个月)。
根据专利,涂覆来自水/乙酸溶液的壳聚糖基双层 | 包被来自碳酸溶液的壳聚糖 | 通过碳酸的顺序应用壳聚糖/万古霉素/透明质酸聚阴离子包被 | |
标准化钙含量,% | 3–6 | ~1.0 | ~0.8 |
4.1 核心创新
本技术以绿色化学为原则,以碳酸溶液替代传统有机溶剂,避免毒性残留;在此基础上,还具有单一涂层同步抗钙化、按需抗菌、更好的机械性能等优势,突破传统涂层功能单一的限制。此外还实现了通过病原微环境触发药物释放,减少系统性抗生素暴露,降低耐药风险。
本技术产品有多方面的应用潜能,不仅可以用作心脏瓣膜来减少钙化和感染性心内膜炎的发生率;还有可能作为血管补片与植入物,这样同样可以发挥其抗钙化、抗感染的优势。若调整聚合物组合,或可适配骨修复、伤口敷料等生物医学场景。
本研究成功开发了一种基于壳聚糖/透明质酸双层聚阴离子的智能涂层技术,通过高压碳酸溶液工艺实现高效负载与结构优化。该涂层在抗钙化、抗菌响应和机械性能方面表现卓越,为生物人工心脏瓣膜的临床改进提供了全新策略。未来工作可进一步探索其他聚电解质组合、涂层长期稳定性及大规模生产工艺,推动其向临床转化。
--RECOMMEND---
·推荐关联阅读·
主动脉瓣反流的超声心动图评估:来自英国超声心动图学会的实用指南
JACC前沿│治疗主动脉瓣狭窄的最佳干预时机
心超医生视角|从心超医生→“瓣膜识别官”→“心门守护者”的角色升华
武汉大学中南医院心血管外科
武汉大学第二临床学院
欢迎联系我们、加入我们



文案&设计:孟庆博
排版:蒋润琦
审核:张慜歆 王霜
联系与投稿方式:296130449@qq.com
推荐
-

-

QQ空间
-

新浪微博
-

人人网
-

豆瓣